lasha-17თერმ 1 კანონი:
სისტამაზე გადაცემული სითბო ხმარდება სისტემის შინაგანი ენერგიის ცვლილებას და სისტემის მიერ მუშაობის შესრულებას
Q = დელტაU + A
მაგ: ვთქვათ აირს გადვეცით Q=100ჯ სითბო. მისი მოხმარების მრავალ შემთხვევათაგან მოვიყვან რამდენიმეს:
1) დელტაU= 60ჯ (აირი გაცხელდა) და A =40ჯ (აირი გაფართოვდა)
2) დელტაU =140ჯ (აირი გაცხელდა) და A = -40ჯ (აირი შეიკუმშა)
3) დელტაU = -20ჯ (აირი გაცივდა) და A = 120ჯ (აირი გაფართოვდა)
3-ვე შემთხვევაში 1 კანონი დაცულია დაცულია... მაგრამ მათგან თავისთავად (შეუქცევადად) განხორციელდებოდა მხოლოდ 1-ლი შემთხვევა.
2) და 3) შემთხვევა კი შესაძლებელია განხორციელდეს მხოლოდ არათავისთავად(ანუ იძულებით, გარეშე ძალის ჩარევით)..
პროცესის თავისთავადობას(შეუქცევადობას) კი განსაზღვრავს თერმოდ მე-2 კანონი (კლაუზიუსის კანონი) რომელიც შეიძლება ასე გამოითქვას:
-შეუძლებელია რომ სითბო თავისთავად გადაეცეს ცივი სხეულიდან ცხელ სხეულს. ანუ თუ ცხელ ჩაიში ჩავაგდებთ ცივ კოვზს, პროცესი თავისთავად აუცილებლად წარიმართება რაღაც შუალედური ტემპერატურისაკენ-სითბური წონაწსწორობის დამყარებამდე
და რაც მთავარია საწყის მდგომარეობაში დაბრუნება(შექცევადობა) თავისთავად აღარ მოხდება.
ამ ადგილას შემოაქვთ სისტემის მდგომარეობის მახასიათებელი პარამეტრის-ენტროპიის (S) ცნება:
dS = dQ/T
ანუ ენტროპიის ცნების შემოტანით თერმოდინამიკის მე-2 კანონი შეიძლება განზოგადდეს:
ბუნებაში თავისთავადი (შეუქცევადი) პროცესები მიმდინარეობენ ენტროპიის ზრდის მიმართულებით..
ახლა ფინალი იწყება. მატჩის დასრულების შემდეგ ენტროპია მეტი იქნება , ვიდრე ახლაა


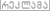

 ·
·